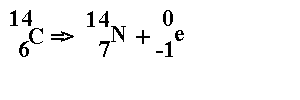
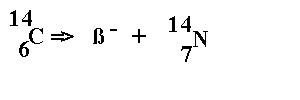
D'où vient le carbone 14 ?
Une partie des neutrons créés dans l'atmosphère par les rayons cosmiques interagissent avec l'azote pour former un isotope radioactif du carbone selon la réaction:
14N(n,p)14C Réaction mise en évidence par W.F. LIBBY en 1946.
Plus précisément, les protons cosmiques d'origine galactique sont plus ou moins déviés par le champ magnétique terrestre. Ceux qui pénètrent dans l'atmosphère donnent naissance à des neutrons sur les molécules d'oxygène et d'azote de l'air. Après leur production, ces neutrons entrent en collision avec les molécules de l'air; à la suite de nombreux chocs, ils sont ralentis et atteignent peu à peu l'énergie thermique des gaz. Ils donnent alors, avec une probabilité quasi- totale, du carbone 14 sur l'azote de l'air. La réaction est la suivante:
146C -> ß- + 147N
Le carbone 14 ainsi formé s'oxyde rapidement, donne une molécule de 14CO2 qui se disperse et marque de façon uniforme par sa radioactivité le gaz carbonique atmosphérique ( ex : absorbé par les plantes au cours de la photosynthèse ) comme le montre le cycle du carbone 14. Le bois vivant contient donc toujours une certaine proportion de carbone 14, et on a constaté que cette quantité était constante dans le monde, chaque gramme de carbone contenant suffisamment d'isotopes 14C pour qu'un détecteur enregistre 13.6 désintégrations par minute et par gramme de carbone ( DPM/g ).
Par exemple, lorsqu'un arbre est abattu, le bois cesse de vivre, le processus de photosynthèse s'arrête, et il n'y a plus absorption de gaz carbonique.
L'isotope 14C est alors libre de se désintégrer sans compensation, selon la réaction suivante :
Le carbone 14 est émetteur radioactif ß-
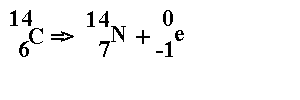
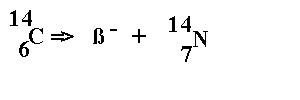
concentration du carbone 14
Le carbone 14 est l'un des isotopes du carbone: son abondance est de 1,2 10-12 %; les deux autres isotopes sont stables , ce sont le carbone 12 et le carbone 13 présents respectivement dans la proportion de 98,89% et de 1,108%.
Période de désintégration
Elle est théoriquement de 5730 ± 40 ans ( Godwin, 1962 ) mais suite à des conventions internationales de la communauté scientifique du radiocarbone pour éviter des confusions, la période utilisée est celle mise en évidence par Willard Libby de 5568 ± 30 ans. Valeur adoptée dès 1951 et qui continue d'être utilisée pour le calcul des âges. Le passage de cette dernière période à la nouvelle se fait en multipliant les âges par le facteur : 1,03.
Courbe de décroissance exponentielle du carbone 14
Au bout de 5568 ans on peut donc s'attendre à ce que le morceau de bois ne donne que 6.8 DPM/g. Il est ainsi possible d'évaluer l'âge d'un spécimen de bois ( ou de tout autre matériau d'origine organique ) d'après son degré de radioactivité.
Cette méthode de datation par le carbone 14 a été appliquée, par exemple à du bois prélevé dans des tombes égyptiennes que les archéologues estimaient vieillies de 4600 ans. On a obtenu un taux de comptage correspondant à un âge de 4500 ans, ce qui était une confirmation frappante du raisonnement des archéologues.
Ainsi, formation et désintégration du carbone 14 se produisent simultanément et se conjuguent pour arriver à un équilibre radioactif qui maintient constantes la composition isotopique et l'activité spécifique du carbone atmosphérique. Donc cette activité naturelle est très faible, et elle a été déterminée comme étant égale à : 13,56 +- 0.07 désintégrations par minute et par gramme de carbone.
Principe de datation
On sait que tout organisme présente de son vivant la même radioactivité que le gaz carbonique atmosphérique. A sa mort, les échanges gazeux cessent, le 14C n'est plus renouvelé, sa radioactivité décroît alors lentement à raison de la moitié tous les 5568 ans, c'est la période de demie-vie.
Ainsi si on mesure aujourd'hui l'activité 14C = At d'un bois, on peut en la comparant à l'activité du carbone moderne Ao, en déduire le temps t qui s'est écoulé depuis sa mort. C'est ce que l'on appelle l'AGE.
L'âge est calculé â partir de la formule de décroissance
exponentielle radioactive:
| At = Ao . e-lembda.t | |
| At | activité carbone de l'échantillon ( échantillon archéologique ) |
| Ao | activité carbone moderne ( échantillon standard de référence ) |
| Lembda | constante de désintégration Ln2/T égale à 0.69314/T |
| T | étant la période de demi-vie du 14C utilisée par convention, soit 5568 ans |
Si on introduit la valeur de la période dans l'équation ci-dessus, on obtient une formule simple pour le calcul des âges:
AGE = log Ao/A * 8,033 103ans
Tel est le principe de la méthode. Il repose sur l'hypothèse que la radioactivité naturelle est restée constante au moins au cours des 40000 dernières années, autrement dit, on suppose que l'activité 14C d'organismes vivants actuellement est identique à celle des mêmes organismes qui ont vécu il y a 10000 ans par exemple.
Cette hypothèse n'est pas rigoureusement
exacte car l'activité du carbone 14 n'a pas toujours
été constante dans le temps c'est à dire qu'il y a eu des fluctuations de
la teneur en 14C
dans l'atmosphère, aujourd'hui quantifiées et qui sont introduites dans les
procédures de
correction et calibrage de âges radiocarbone. Cf limites
de la méthode.
Le principe de la méthode de datation par le 14C consiste donc à mesurer l'activité spécifique d'un échantillon, qui est le nombre de rayons ß- émis par gramme de carbone et par minute, et en déduire par le calcul, le temps écoulé depuis la mort de l'organisme sur lequel l'échantillon a été prélevé.
La découverte de W.F. Libby, qui lui valut l'attribution du prix Nobel de Chimie en 1960, fut d'expliquer la teneur en 14C de toute matière carbonée. W.F. Libby montra que le bombardement de l'azote par des neutrons se produisait de façon continue dans la nature et que le produit de cette réaction, le radiocarbone, faisait partie intégrante de certaines matières carbonées de la nature.
Distribution du carbone 14 dans la nature
Les différents réservoirs de radiocarbone sur Terre
Parmi les éléments présents à la surface de la terre, le carbone est l'un des plus importants. Il est très diversement réparti :
- sous forme de gaz carbonique dans l'atmosphère,
- sous forme de composés organiques dans la biosphère terrestre et marine,
- sous forme de gaz carbonique, de bicarbonates dissous et de carbonates dans les océans.
Des échanges constants de carbone se produisent dans ce système qui constitue le système échangeable.
La répartition du carbone dans l'atmosphère est connue avec une assez bonne précision.
C'est dans la biosphère terrestre qui comprend la matière végétale vivante et morte, c'est à dire les végétaux et les sols, que l'on a le moins d'information.
Le carbone est, par ailleurs, beaucoup plus abondant dans le système sédimentaire constitué par les roches sédimentaires calcaires, les sédiments marins, les charbons et le pétrole. Dans les roches de formation très ancienne, le carbone est totalement dépourvu de 14C ( exemple donné pour quelques millions d'années ).
Les différents réservoirs sont supposés en équilibre réciproque vis à vis de la teneur en 14C qui est elle-même homogène dans chacun d'entre eux est considérée comme constante puisque l'équilibre radioactif est atteint ( taux de production = taux de désintégration ).
L'équilibre est rompu lorsque cesse l'interconnexion de l'un des réservoirs et seule la décroissance radioactive se produit dans le réservoir isolé.
Il est donc possible de connaître le moment où le réservoir a été isolé, donc de dater cet événement, à condition que l'échantillon n'ait pas à nouveau participé ultérieurement d'une façon quelconque au cycle du carbone.
A la surface des océans la plus grande partie du carbone présent dans l'air s'échange avec celui dissous dans les eaux marines et entre dans la constitution des organismes marins; l'autre partie, par la photosynthèse, constitue plus ou moins directement les cellules de tous les organismes terrestres.
Pour que l'activité spécifique de 13,6 dpm/g de carbone reste constante, il faut que le système d'échange matière carbonée-atmosphére reste ouvert. S'il se ferme pour une cause quelconque, telle que la mort de l'organisme ou la précipitation de calcaire, la teneur en 14C va immédiatement commencer à décroître et continuera à le faire régulièrement jusqu'à la disparition totale des isotopes radioactifs qui ne sont plus renouvelés.
Donc la teneur en radiocarbone sera d'autant plus basse qu'il se sera écoulé plus de temps depuis l'interruption de l'échange avec la source de radiocarbone.